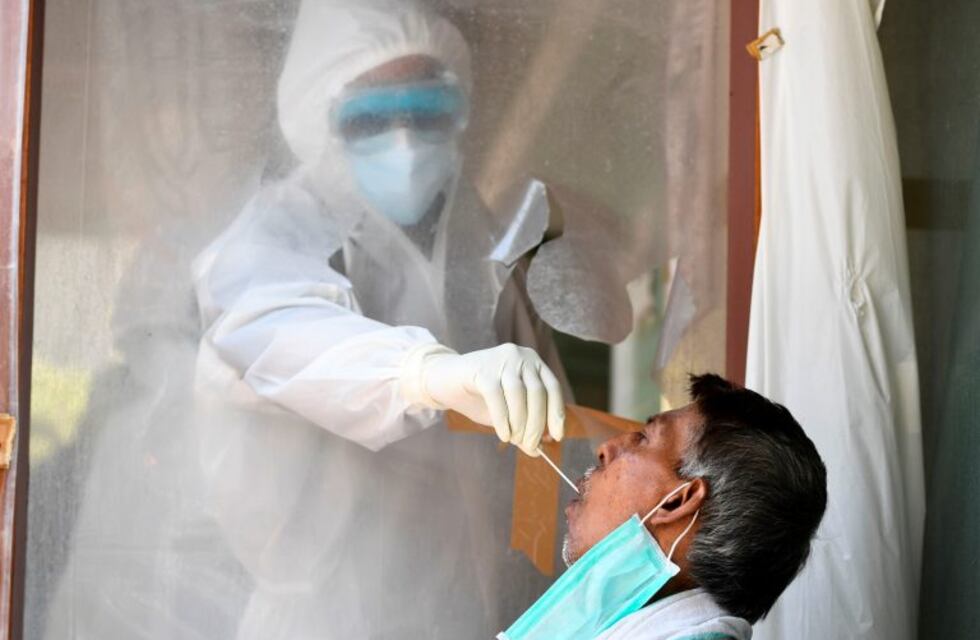
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) emitió la autorización para la primera prueba de COVID-19 de autodiagnóstico en casa que proporciona resultados en unos 30 minutos. La prueba ‘Lucira COVID-19 All-In-One Test Kit’ se podrá adquirir solamente con receta médica para realizar el test en el hogar con muestras de hisopado nasal en personas de 14 años o más que son sospechosas de tener coronavirus.
El kit de la compañía Lucira Health, es una prueba molecular de un solo uso que funciona tomando una muestra con hisopo nasal y arroja el resultado mediante un led luminoso en el dispositivo de lectura, que indica positivo o negativo en COVID-19. Su uso también esta autorizado para consultorios médicos, hospitales, centros de atención urgente y urgencias para todas las edades, sin embargo las muestras deben ser recogidas por un médico cuando la prueba se utiliza para examinar a los individuos menores de 14 años.

El test funciona haciendo girar el hisopo de la muestra recogida en un vial que luego se coloca en la unidad de prueba y en 30 minutos o menos, los resultados pueden leerse directamente en la pantalla luminosa de la unidad de prueba que muestra si una persona es positiva o negativa para el virus del SARS-CoV-2. Además, los médicos que prescriben la prueba están obligados a comunicar todos los resultados de las pruebas que reciben de las personas que las utilizan a las autoridades de salud pública, de conformidad con los requisitos locales, estatales y federales.
Lucira Health, el fabricante de la prueba, también ha elaborado un etiquetado de la caja, instrucciones de referencia rápida e instrucciones para los proveedores de atención de la salud para ayudar a la presentación de informes. ”La FDA continúa demostrando su velocidad sin precedentes en respuesta a la pandemia. Si bien se han autorizado las pruebas de diagnóstico de COVID-19 para su recolección en el hogar, ésta es la primera que puede ser totalmente autoadministrada y proporcionar resultados en el hogar. Esta nueva opción de pruebas es un importante avance diagnóstico para abordar la pandemia y reducir la carga pública de la transmisión de la enfermedad”, indicó el comisionado de la FDA, Stephen M. Hahn.
En Argentina
En el marco del novedoso producto norteamericano, la Cámara Argentina de Laboratorios de Análisis Bioquímicos (CALAB) encendió algunas alarmas, ya que “hay que tener en cuenta que el COVID-19 contagia” y, por lo tanto, “las consecuencias de su mal uso son graves”. También remarcaron que los test rápidos para COVID-19 que actualmente hay en nuestro país no son productos de venta libre. Por lo tanto, es ilegal ofrecerlos en farmacias, supermercados, ventas ambulantes, a través de sitios Web o redes sociales.

“Los test rápidos sólo pueden ser ofrecidos por laboratorios clínicos. Se necesitan profesionales especializados y condiciones e instalaciones adecuadas. El resultado solo es válido si está avalado por un bioquímico”, señalaron desde CALAB.
En nuestro país existen 223 reactivos de uso in vitro para COVID-19 autorizados por la ANMAT, que se dividen en tres tipos: para la detección (PCR), las pruebas serológicas (detectan la presencia de anticuerpos) y los test rápidos de antígenos.
Con información de DPA.